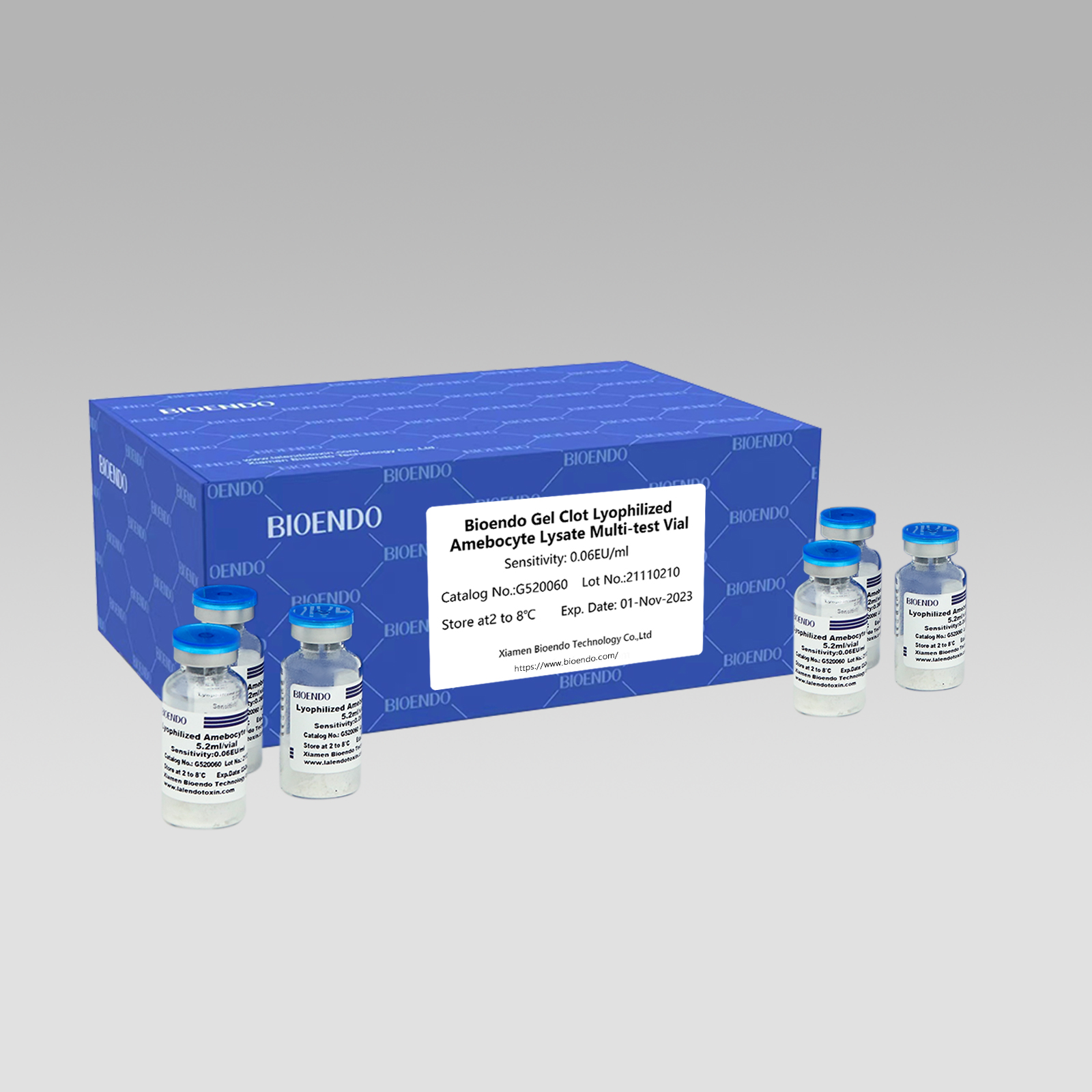
Ĝelo Clot Lyophilized Amebocyte Lysate Multi-test Vial G52
Bioendo G52 serio estas ĉefe uzata en la eksperimenta operacio deprovo de bakteria endotoksinokiel Bioassay proceduro.
1. Produktaj Informoj
Gel Clot-metodo Lyophilized Amebocyte Lysate Multi-test Vial estas la Lyophilized Amebocyte Lysate reakciilo kiu elektas kaj uzas ĝelan embolteknikon por detekti endotoksinon aŭ pirogenon.
Kiel la ĝeneraligita metodo, ĝel-koagultesto por endotoksino estas simpla kaj ne postulas specifan kaj multekostan instrumenton.Bioendo provizas Gel Clot Lyophilized Amebocyte Lysate - LAL-reakciilon en 5.2ml per fiolo.
2. Produktaj Parametroj
Senteveco: 0.03EU/ml, 0.06EU/ml, 0.125EU/ml, 0.25EU/ml, 0.5 EU/ml
3. Produkta Apliko
Finprodukta endotoksino (pirogena) kvalifiko, akvo por injektoendotoksina analizo, kruda materialotestado de endotoksinojaŭ endotoxin-nivela monitorado dum produktada procezo por farmaciaj kompanioj aŭ fabrikantoj de medicinaj aparatoj.
Notu:
Lyophilized Amebocyte Lysate (LAL-reakciilo) produktita fare de Bioendo estas farita de lisato de amebocitoj (blankaj globuloj) de la hufumkrabo.
Ĉi tiu unika reakciilo fariĝis esenca ilo en la farmaciaj kaj medicinaj aparataj industrioj por la detekto de bakteriaj endotoksinoj.La amebocitoj de la hufumkrabo enhavas substancon nomitan Lyophilized Amebocyte Lysate, kiu reagas al bakteriaj endotoksinoj formante ĝel-similan embolon.Ĉi tiu reago estas la bazo por la LAL-testo, uzata por certigi la sekurecon de medicinaj aparatoj, drogoj kaj aliaj produktoj, kiuj kontaktas la homan korpon.
La uzo de LAL-reakciilo revoluciis la procezon dedetekto de endotoksinojen la medicina kampo ol la Rabit-testo.Ĝia senekzempla sentemo kaj specifeco igas ĝin decida komponanto en la kvalito-kontrolo kaj sekureca certigo de farmaciaĵoj, biologiaj kaj medicinaj aparatoj.La LAL-testo estas rapida kaj fidinda metodo pordetekto de endotoksinoj, provizante rezultojn en nur 60 minutoj.Ĉi tiu efikeco permesas rapidajn kaj precizajn decidojn pri la liberigo de produktoj, finfine plibonigante la ĝeneralan sekurecon kaj efikecon de kuracaj traktadoj kaj aparatoj.
La Lyophilized Amebocyte Lysate (LAL-reakciilo) de Bioendo estas produktita sub striktaj kvalitnormoj por certigi ĝian efikecon kaj fidindecon.La firmao estas dediĉita al utiligado de daŭrigeblaj praktikoj en la rikoltado de hufumkraboj por minimumigi ajnan negativan efikon al ilia populacio.Priorigante la bonfarton de ĉi tiuj estaĵoj, Bioendo certigas daŭran provizon de ĉi tiu valora rimedo por la produktado de LAL-reakciiloj.Aldone, daŭraj esplor- kaj disvolvaj klopodoj koncentriĝas pri plibonigo de la agado kaj ĉiuflankeco deLAL-testa endotoksino, plue antaŭenigante ilian servaĵon en la medicinaj kaj farmaciaj industrioj.
Metodo de ĝelo-koagulaĵoLAL-analizo, rekonstruita liza reakciilo ricevas almenaŭ 50 testojn per fiolo:
| Katalogo-Numero | Sentemo (EU/ml aŭ IU/ml) | ml/fiolo | Testoj/Vial | Fioloj/Pako |
| G520030 | 0.03 | 5.2 | 50 | 10 |
| G520060 | 0.06 | 5.2 | 50 | 10 |
| G520125 | 0.125 | 5.2 | 50 | 10 |
| G520250 | 0.25 | 5.2 | 50 | 10 |
| G520500 | 0.5 | 5.2 | 50 | 10 |
Produkta kondiĉo:
La Lyophilized Amebocyte Lysate - LAL-reakciilo-sentemo kaj la Control Standard Endotoxin-potenco estas analizitaj kontraŭ USP Reference Standard Endotoxin.La Liofiligitaj Amebocyte-reakciiloj venas kun produkta instrukcio, Atestilo pri Analizo, MSDS.
Kio estas la diferenco inter Bioendo unutesta fiolo kaj multobla testa fiolo?
● Sola provo: rekonstruu la unuopaĵonLimulus-lysate-testoaŭ vokitalimulus amebocitoper BET-akvo en la vitra fiolo aŭ vitra ampolo.
● Multi-testo: rekonstruu la lizatan reakciilon kun BET-akvo, kaj tiam aldonu markitan kvanton da lisata reakciilo sekvante COA al la reakcia tubo aŭ putoplato por uzo.Ne estas diferenco en la specimena antaŭ-prilabora proceduro;laŭ la kvanto de testado uzata, la specimena grandeco uzata por ununura testo estas pli granda ol la specimena grandeco uzata por multoblaj testoj.
Kial la ĝelo-atestilo G52 speciala por amaso da specimenoj kvanto?
1. Multitesta LAL-reakciilo por endotoksin-detekto en la aplikoj de la proceduroj de LAL-analizaj operacioj de masaj specimenoj.
2. G52-serio de Ĝelo-coagulo endotoksin-analizo multi-test-vitra fiolo ne bezonas kompleksan leganton de mikroplatoj.En LAL-analizo ĝia proceduro de kovado per akvobano aŭ seka varmo-inkubatoro estas oportuna aparato.
3. Alta kvalito de endotoxina libera tubo (<0.005EU/ml) kaj Alta kvalito de pirogenaj pintoj (<0.005EU/ml) kiel garantiitaj konsumeblaj por certigi la ĝustan rezulton.
4. Elekti Bioendo-ununura LAL-test-fiolo aŭ mult-LAL-test-fiolo laŭ specimena kvanto, la celo estasLAL-testo por pirogenojdetekto.
Rilataj produktoj en la provo de endotoksino:
Akvo por Bakteriaj Endotoksinoj Testo (BET), Rekomendi TRW50 aŭ TRW100
Sen endotoksina vitra tubo (dilua tubo), Rekomendi T1310018 kaj T107540
Senpirogenaj konsiletoj, Rekomendi PT25096 aŭ PT100096
Pipetisto, Rekomendi PSB0220
Provo Tuba Rako
Inkubacio Instrumento (Akva Bano aŭ Seka Varmo Inkubatoro), rekomendi Bioendo Seka Varmo Inkubatoro TAL-M2 estas 60 truoj unu modula.
Vortex Mixter, Rekomendi VXH.
Kontrolo Standard Endotoxin, CSE10V.